II Comment anesthésie t-on ?
Anesthésie Chimique
Ensuite, la question se pose : comment anesthésie-t-on ? L’anesthésie chimique générale et l’hypnosédation ont toutes les deux le même but lors d’une opération; cependant leur fonctionnement est différent.
Tout d’abord, l’anesthésie chimique générale est obtenue par des agents appelés anesthésiques généraux dont il existe trois composants différents : les analgésiques, les hypnotiques et les curares. Ils peuvent être administrés par voie intraveineuse ou par inhalation.
1) Les analgésiques
Les analgésiques, qui ont pour but d’éliminer la douleur, ont un fonctionnement particulier dans le corps humain. L’analgésique le plus utilisé lors d’une opération et qui est également le plus connu est la morphine de formule chimique C17H19NO3 (formule topologique ci-contre) car c’est un isomère (molécule ayant la même formule brute mais qui possède plusieurs formules développées différentes). C’est un alcaloïde (molécule organique d’origine végétale possédant des propriétés thérapeutiques ou toxiques) qui provient de l’opium. Elle agit comme l’ensemble des analgésiques sur les douleurs nociceptives (douleur ayant pour origine une lésion tissulaire). Elle a donc une action sur les récepteurs sensibles à la douleur évoqués dans la première partie que sont les nocicepteurs. Pour démontrer cet effet, on peut réaliser une expérience : on prend deux individus en bonne santé, le premier servant de témoin de l’expérience et le second chez qui on injecte une dose de morphine, et l’on mesure à l’aide d’un électroencéphalogramme (étude globale du cerveau avec la visualisation de ses rythmes) les différents potentiels d’action par seconde au niveaux des différents neurones nociceptifs :

Formule topologique de la morphine



On remarque que le témoin qui n’a pas reçu de dose de morphine possède des potentiels d’action 2 à 5 fois plus élevés que ceux de l’individu ayant reçu une dose de morphine dans les mêmes neurones, en particulier pour les douleurs plus longues et plus fortes normalement causées par la stimulation des fibres C (en orange ici) qui passent d’environ 50 PA par seconde sans morphine à environ 10 PA par seconde avec cet antalgique. On peut donc en déduire que la morphine comme l’ensemble des antalgiques combat la douleur dans le but de l’éliminer.
Ensuite, pour déterminer l’origine de ce fonctionnement, on peut refaire l’expérience ci-dessus en gardant le témoin, mais en injectant en plus du naloxone (substance qui est capable de se fixer sur certains récepteurs synaptiques, les récepteurs opioïdes) chez l’individu ayant déjà reçu une dose de morphine. On mesure à nouveau à l’aide d’un électroencéphalogramme les différents potentiels d’action par seconde au niveaux des différents neurones nociceptifs :
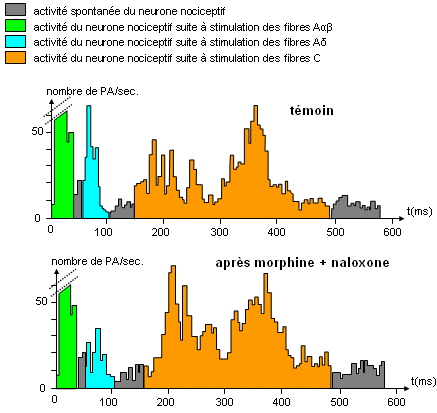
On constate que le témoin et l’individu ayant reçu une dose de naloxone ajoutée à une de morphine possèdent environ les mêmes potentiels d’activité. La morphine n’a donc plus d’effet sur la douleur en présence de naloxone. Le potentiel d’action est même plus élevé pour les douleurs liées à la stimulation des fibres C chez l’individu ayant reçu une dose de naloxone ajoutée à une de morphine que chez le témoin. Vu que le naloxone a la particularité de se fixer sur les récepteurs opioïdes qui sont des récepteurs synaptiques, c’est-à-dire que cela empêche tout autre molécule (comme la morphine) de les activer, on peut déduire le fonctionnement de la morphine et de l’ensemble des analgésiques : ils agissent en se fixant sur ces récepteurs opioïdes, ce qui permet d’éliminer la douleur.
Enfin, il faut comprendre comment le fait que la morphine se fixe sur ces récepteurs permet d’éliminer la douleur. Premièrement, puisque la morphine n’est pas produite pas le corps humain et lui est donc étrangère, la présence de récepteurs opioïdes permet de déduire l’existence d’une autre molécule qui est complémentaire de ces récepteurs. De plus, vu que la morphine permet d’éliminer la douleur, on peut émettre l’hypothèse que cette molécule diminue également la douleur. Cette molécule est en fait l’enképhaline, plus communément appelé l’endorphine, représentée ci-dessous fixée à un récepteur opioïde. Une molécule de morphine est également représentée dans la même situation :

On remarque que ces molécules possèdent une structure spatiale identique au niveau de la partie se fixant aux récepteurs opioïdes, c’est pourquoi ces deux molécules se fixent sur ces récepteurs. On peut donc déduire que la morphine a les mêmes effets que l’enképhaline sur le corps humain. Vu que l’enképhaline est une molécule produite par l’organisme et qui est libérée par les neurones pour réduire le potentiel d’action produit par une douleur en bloquant l’afflux d’ions Ca2+ pour empêcher la libération de substance P qui est le neuromédiateur de la douleur (molécule chimique qui assure la transmission des messages d'un neurone à l'autre (ici de la douleur), au niveau des synapses) ; c’est-à-dire qu’elle diminue la sensation de douleur, la morphine permet donc d’éliminer la douleur comme l’ensemble des analgésiques en s’ajoutant aux molécules d’enképhalines déjà présente dans l’organisme.
2) Les hypnotiques
Ensuite, les hypnotiques, qui ont pour but l’endormissement du patient, présentent également un fonctionnement particulier. Aujourd’hui, les principaux hypnotiques utilisés sont les benzodiazépines. Ce terme vient d’ « azépine » qui désigne un hétérocycle (chaîne fermée d’un composé organique cyclique dont certains atomes ne sont pas des carbones), qui est un cycle de benzène dans lequel un atome de carbone a été remplacé par un atome d’azote, du terme « di » signifiant que deux atomes de carbone ont été remplacés de cette façon (par deux atomes d’azote), et du terme « benzo » indiquant ici l’ajout de deux cycles benzéniques (C6H6, voir formule topologique ci-contre). Pour être hypnotique, ces benzodiazépines doivent être de la famille des benzodiazépines 1-4 (il existe également des benzodiazépines 1-5 et des 2-3) ; c’est-à-dire que les atomes d’azote doivent être aux positions 1 et 4. La formule topologique générale de cette famille d’hypnotique est donc :

Fomule topologique du benzène

Le nitrazépam de formule C15H11N3O3 (voir formule topologique ci-contre) est la principale molécule des benzodiazépines utilisée en anesthésie. Il possède un groupe nitro NO2 lié au carbone en position 7 au lieu d’un hydrogène (tous les atomes d’hydrogène liés aux carbones en position 7 sont remplacés chez les benzodiazépines) qui va lui donner un effet hypnotique. Plus l’électronégativité du substituant (ici NO2) est élevée, plus la molécule est puissante et donc plus elle est efficace. L’action hypnotique du nitrozépam est donc forte vu qu’elle possède ce groupe nitro NO2 qui est très électronégatif.
Cette molécule comme l’ensemble des benzodiazépines agit sur le message

Formule topologique du nitrazépam
nerveux au niveau des récepteurs au GABA (l'acide gamma-aminobutyrique) de type A qui sont appelés les récepteurs GABA, et qui sont présents sur certains neurones au niveau des synapses dans le cerveau. Ce type de récepteurs est capable en effet de reconnaître des substances pharmacologiquement actives, comme les benzodiazépines. La molécule de nitrozépam va en effet augmenter l’activité de ces récepteurs en se fixant dessus, ce qui va élever la fréquence d’ouverture du canal chlore lorsque les neurotransmetteurs GABA sont libérés dans la synapse à la suite d’un influx nerveux et seront également fixés sur ce même récepteur. Plus d’ions chlorure Cl- vont donc pouvoir passer dans les neurones post-synaptiques qu’en l’absence de nitrozépam. Grâce au passage de ces ions, ces neurones post-synaptiques vont être hyperpolarisés, ce qui va les rendre moins excitables vu que ce canal est inhibiteur, ce qui va permettre le sommeil. En effet, cette inhibition (baisse ou arrêt de l’activité d’une cellule ou d’un ensemble de cellules nerveuses) permet d’empêcher les envois ou une partie des envois de messages nerveux notamment ceux de la douleur lors d’une opération vers la formation réticulée qui est responsable de l’éveil, comme cela est évoqué dans la première partie. Cette absence de message nerveux ou d’une grande partie de ces messages va donc permettre le sommeil.
De plus, la durée d’action de ces benzodiazépines est variable en fonction des molécules avant d’être éliminées dans l’urine et les fèces. En cas d’urgence, le propofol de formule C12H18O (formule topographique ci-contre) qui est un hypnotique également mais qui n’est pas une benzodiazépine, peut être utilisé pour endormir très rapidement le patient pour une durée de 5 minutes. Il utilise le même mode de fonctionnement que les benzodiazépines en se fixant également sur les récepteurs au GABA.
On peut donc conclure que les benzodiazépines sont des agonistes (substance (ici les benzodiazépines) qui se fixe sur les mêmes récepteurs cellulaires (ici les récepteurs au GABA) qu’une substance de référence (ici les neurotransmetteurs GABA) et qui produit, au moins en partie, les mêmes effets) responsables de l’induction lors d’une anesthésie.
Schéma du mode d'action des benzodiazépines au niveau d’une synapse


Formule topologique du propofol
3) Les curares
Enfin, les curares, qui ont pour but le relâchement musculaire, possèdent aussi un fonctionnement particulier. Il existe deux types de curares : les curares dépolarisants et les curares non dépolarisants. Ils agissent tous les deux au niveau des jonctions musculaires. Cependant, ils ne sont pas toujours utilisés lors d’une opération car ils demandent un contexte et un environnement adaptés car les voies aériennes doivent être contrôlées (le patient doit être ventilable et utilisation de matériel d’intubation).
Les curares dépolarisants sont généralement utilisés lors des opérations en cas d’urgence vu qu’ils possèdent une action très rapide (30 à 60 secondes). Le principal curare dépolarisant est la succinylcholine, aussi appelé suxaméthonium, de formule C14H30N2(O4)2+. Elle possède le même rôle que l’acétylcholine, qui est le neurotransmetteur responsable de la contraction musculaire, comme l’explique la première partie. Dans un premier temps, cette molécule de succinylcholine va en effet se fixer sur les mêmes récepteurs nicotiniques que l’acétylcholine, les canaux ioniques vont donc s’ouvrir et des ions sodium Na2+ vont passer dans la fibre musculaire, ce qui va entraîner la dépolarisation du muscle donc sa contraction. Cependant, la succinylcholine n’est pas détruite contrairement à l’acétylcholine qui l’est par l’acétylcholinestérase. La molécule de ce curare dépolarisant reste donc fixée sur les récepteurs nicotiniques, ce qui va entraîner une dépolarisation donc la contraction prolongée du muscle, qui va se décontracter seul au bout de quelques minutes. La paralysie est également prolongée car les récepteurs nicotiniques de l’acétylcholine sont désensibilisés.
Il existe plusieurs molécules de curares non dépolarisants, qui sont choisies en fonction de leur rapidité, de leur durée d’utilisation et de leurs éventuels effets secondaires. Ils peuvent être de deux types : les curares non dépolarisants stéroïdiens comme le vécuronium de formule chimique C34H57N2(O4)+ et les non stéroïdiens comme le cisatracrium de formule C53H72N2(O12)2+. Ils vont également se fixer sur les récepteurs nicotiniques de l’acétylcholine par complémentarité de forme mais vont avoir un mode d’action différent. En effet, contrairement aux curares dépolarisants, ils empêchent l’acétylcholine d’intervenir sur les récepteurs nicotiniques, les canaux ioniques ne peuvent donc pas s’ouvrir et les ions sodium Na+ ne passent pas dans les fibres musculaires, ce qui fait qu’il n’y a pas de dépolarisation et donc pas de contraction. Pour que cette absence de contraction soit possible, 75% des récepteurs nicotiniques doivent être occupés par des molécules de curares non dépolarisants. En effet, assez peu de molécules d’acétylcholine sont nécessaires sur ces récepteurs pour permettre l’ouverture des canaux ioniques entraînant le passage des ions sodium Na+ donc la dépolarisation et la contraction des muscles. Ces molécules ne sont également pas détruites par l’acétylcholinestérase, le muscle restera donc décontracté. Ces molécules de curares non dépolarisants sont donc des antagonistes de l’acétylcholine (substance se fixant sur les mêmes récepteurs cellulaires qu'une substance de référence, en empêchant celle-ci de produire tout ou partie de ses effets habituels).
Hypnosédation

Schéma d'une jonction musculaire en présence de curares non dépolarisants (gauche) et sans (droite)
a) Hypnose
L’hypnosédation est une pratique permettant une anesthésie générale chez le patient. Elle est composée de deux éléments majeurs :
-
l’hypnose médicale qui permet de focaliser l’attention du patient sur autre chose que l’opération en elle-même. De cette façon, la réalité, qui pourrait être mal vécue, est transformée en un moment agréable.
-
certains sédatifs et/ou une anesthésie loco-régionale qui complètent l’hypnose afin de lutter contre l’inconfort et/ou d’augmenter la relaxation.
Une définition scientifique de l’état d’hypnose est difficile à donner en l’état actuel des connaissances et varie beaucoup selon les professionnels. Cependant, tous semblent s'accorder sur le fait qu’il s’agit d’une expérience agréable pour le patient et que cet état relève d’un état de conscience modifiée, donc d’un état neurophysiologique particulier.
Dans cette partie, il va être démontrer qu’un patient sous hypnose acquiert un état de conscience modifiée, et en quoi cette modification engendre une diminution, voire une absence, du ressenti de la douleur ainsi qu’un relâchement musculaire et une induction.
Tout d’abord, il est intéressant de connaître les différentes parties du cerveau liées à la douleur ainsi que leur rôle pour voir en quoi celle-ci est diminuée sous état d’hypnose. Les voies de la douleur sont réparties en trois catégories, qui sont les différentes composantes de la douleur :
-
composante sensorielle encodée principalement par l’insula et le cortex somatosensoriel. Elle permet à l’individu d’interpréter les différentes sensations (picotement, pincement..), sa localisation et son intensité.
-
composante émotionnelle encodée notamment au niveau du cortex cingulaire antérieur qui signale à l’individu l’inconfort (agacement, épuisement..)
-
composante cognitivocomportementale encodée par le cortex préfrontal et prémoteur. Elle permet à l’individu d’interpréter la douleur et de modifier, en conséquence, son comportement.

Ainsi, pour connaître ce qui résulte d’une diminution du ressenti de la douleur sous hypnose, il faudra étudier en quoi le fonctionnement de ces différentes zones du cerveau se modifie lors de cet état.
Le changement d’activité cérébrale le plus étudié jusqu’à aujourd’hui est le changement de fonctionnement du cortex cingulaire antérieur, qui est une structure cérébrale impliquée dans le contrôle de l’attention, de la motricité et de la douleur.
La première étude réalisée concernant cette structure cérébrale a eu lieue en 1997 par Pierre Rainville. Son expérience consistait à maintenir un stimuli douloureux constant (la main gauche de l’individu restait plongée dans une eau à 47°C). Lorsqu’il suggérait aux patients sous hypnose que leur inconfort augmentait (sans rien modifier réellement), il observait une augmentation de l’activité du cortex cingulaire antérieur. Il a donc supposé que celui-ci jouait un rôle majeur dans le ressenti émotionnel suscité par le stimuli douloureux.
Une seconde expérience a eu lieue afin de connaître davantage le fonctionnement du cortex cingulaire antérieur. En 1999, Pierre Macquet et al. réalisent une expérience. Celle-ci consiste à appliquer sous les mains de plusieurs individus une plaque électrique chauffée jusque 48°C pendant 15 secondes, puis de diminuer la température et de recommencer. Grâce à la TEP (tomographie par émission de positrons), ils observent la réponse cérébrale de ce stimuli dans 3 situations différentes :
-
la 1ere : les yeux fermés, au repos et sans suggestion.
-
la 2e : au repos, avec le rappel d’un souvenir agréable.
-
la 3e : sous hypnose, avec le rappel d’un souvenir agréable.
Suite à cette expérience, ils remarquent, chez les individus sous hypnose, une augmentation proportionnelle du débit sanguin dans la partie du cortex cingulaire antérieur. Ils en déduisent donc que l’activité augmente dans cette région du cerveau pour que l’individu puisse mieux gérer sa douleur.

Les images couleurs montrent l’aire du cortex cingulaire antérieur (CCA) dont l’activité corrèle avec le sentiment de désagrément (Rainville et al. 1997). L
Une expérience complémentaire a permis de montrer que le débit sanguin d'un individu sous hypose augmente également en fonction de l’intensité de la douleur dans un réseau de régions corticales et sous-corticales (zones cérébrales situées sous la surface du cortex, c’est-à-dire les ganglions de la base, l’hippocampe et les amygdales du système lymbique qui sont rassemblés au centre de l’encéphale). Celles-ci sont liées au cortex cingulaire antérieur. Une augmentation du débit sanguin est également remarquée dans le cortex prégénual (structure cérébrale impliquée dans les processus cognitif et émotionnel) et dans la pré-SMA et la striatum (structures cérébrales impliquées dans les processus moteurs). Ces zones cérébrales traitent l’information nociceptive afin d’activer d’autres zones du cerveau responsables de la réponse comportementale et motrice de la douleur. L’hypnose entraîne donc un traitement de l’information nociceptive par ce réseau (normalement de moindre activité), cela permet donc à l’individu de mieux gérer la douleur.
Une autre expérience, par IRMF (Imagerie par Résonance Magnétique Fonctionnelle, a également mis en évidence l’augmentation de l’activité des ganglions de la base. Cela conforte l’idée que le traitement en réseau pourrait servir à moduler l’information nociceptive.
Sous état d’hypnose, on remarque une baisse d’activité, voire une désactivation, du précuneus et du cortex cingulaire postérieur. Le précuneus est une région du cortex pariétal qui joue un rôle dans l’imagerie visuo-spatiale c’est-à-dire la perception de soi par rapport à l’environnement. Le cortex cingulaire postérieur permet une intégration des modalités sensorielles, c’est-à-dire qu’il permet l’unification des différentes composantes de la douleur.
L’inhibition de ces deux régions cérébrales engendre la diminution de la conscience de soi dans le monde extérieur et du ressenti de la douleur. D’un point de vue psychologique, elle permet la désactivation du facteur critique (mécanisme qui permet de comparer, juger..).
Ces deux régions sont très actives lorsqu’un individu est éveillé, même lorsqu’il est au repos. Cependant, la désactivation de ces régions a déjà été observée lors d’états végétatifs (également caractérisés comme un état de conscience modifiée).

A l’inverse, sous état d’hypnose, une activation de certaines zones du cerveau est observée. Tout d’abord, on remarque l’activation de la zone pariétale qui est responsable des sensations. En état de conscience “normal”, cette zone est active lorsque l’individu est en mouvement. De plus, la zone occipitale, appelée aussi lobe occipital, est active. Elle est responsable de la vision ; en état de conscience “normal”, cette zone est active lorsque l’individu voit quelque chose, c’est-à-dire lorsqu’il ouvre les yeux ; or, sous hypnose, bien que cette zone soit active, l’individu ferme les yeux.
Enfin, la zone précentrale est elle aussi active. Celle-ci est responsable de la motricité, elle est normalement active lorsqu’un individu bouge ; or, sous hypnose, il est immobile.
L’activation de ces 3 zones facilitent la communication entres les deux hémisphères cérébraux. L’hypnose permet donc de connecter des zones cérébrales qui, habituellement, ne sont pas connectées de façon aussi efficace.
De plus, l’activation de ces 3 zones, sous un état d’hypnose, concorde avec le fait que les patients ont réellement l’impression de “revivre” leurs souvenirs, et non pas simplement de s’en rappeler, comme lors de l’évocation de souvenirs sous un état de conscience “normal”.
Enfin, à l’aide d’un électro-encéphalogramme, l’activité cérébrale peut être mesurée. En effet, dans notre cerveau, 100 milliards de neurones échangent en continu des informations. Ces dernières peuvent être transmises grâce à des ondes dites cérébrales. Leur rythme (en cycles/secondes) est donc mesuré par l’électro-encéphalogramme. Comme c'est une fréquence, l’unité est le Hz (hertz). Selon notre activité, ce rythme varie. Il a donc été classifié en 4 rythmes différents :
-
le rythme “onde Beta” correspond à un plein éveil lors duquel l’individu est en action ou en réflexion par exemple. La fréquence électrique est d’environ 15 à 21 cycles/seconde. Dans ce rythme, l’hémisphère gauche est généralement dominant. Celui-ci privilégie un travail analytique de la mesure et de la synthèse, souvent au détriment de la perception intuitive et globale. Pendant un sommeil léger ou sommeil paradoxal, l’individu peut connaître des pics d’activité Beta.
-
le rythme “onde alpha” (composé de 4 sous-niveaux) correspond à un état de relaxation (individu allongé, détendu, dans une position confortable, relâché, reposé) qui permet un relâchement musculaire. A ce rythme, les ondes cérébrales se ralentissent pour atteindre entre 8 à 14 cycles/seconde. Les ondes alpha circulent globalement dans tout le cerveau, c’est pourquoi, à ce rythme, les deux hémisphères arrivent à fonctionner ensemble dans une bonne harmonie. C’est le rythme qu’un individu atteint sous hypnose légère.
-
le rythme “onde thêta” correspond à une fréquence entre 4 à 8 cycles/seconde. Il correspond à un état d’hypnose profonde, voire parfois à un état de somnolence. Il permet une sensibilité moindre à la douleur.
-
le rythme “onde delta” correspond à une fréquence inférieure à 4 cycles/seconde. C’est le rythme d’un sommeil très profond, il est normal chez de jeunes enfants mais peut caractériser des lésions cérébrales chez les adultes. A ce rythme, seules les fonctions vitales sont assurées.
b) Anesthésie locale ou loco-régionnale
En plus de l’hypnose, l’hypnosédation inclut une anesthésie locale ou loco-régionale.
Cette anesthésie est injectée soit en intradermique (le produit est projeté entre l’épiderme et le derme) soit en sous-cutané (le produit est directement projeté sous l’hypoderme) ou en intraveineuse (directement dans le sang).

La molécule de l’anesthésiant se compose de 3 parties : un cycle lipophile (soluble avec des substances apolaires, comme des corps gras), une chaîne intermédiaire et un ammonium tertiaire (deux atomes liés à un atome d’azote) et hydrophile (ayant une tendance à se dissoudre dans l’eau).
Voici l’exemple ci-contre des ethers et des amides.


L'anesthésiant local agit sur les cellules nerveuses.
Ces fibres nerveuses sont entourées d’une membrane, elle-même entourée de canaux sodiques qui sont composés de récepteurs.
L’anesthésiant local arrive par le sang et se fixe à un récepteur spécifique des canaux sodiques (Canaux transportant les ions sodium à travers les membranes des cellules) . Il va ensuite bloquer les mouvements ioniques, en effet il va empêcher l’entrée des ions Na+ dans les fibres. En bloquant cet accès de part et d’autre de la membrane, l’anesthésiant diminue la fonction de l’influx le long de la fibre. La membrane de la fibre va perdre de l’imperméabilité et l’anesthésiant pourra rentrer dans la cellule en traversant cette membrane sous forme neutre pour retrouver sa positivité à l’intérieur de la cellule. Cet échange d’ions provoque une diminution du potentiel d’action, ce qui veut dire que les synapses ne libéreront pas un neurotransmetteur et le cerveau ne sera pas averti de ce qui se passe dans la partie anesthésiée.
c) Sédation
En plus de quelques anesthésiants chimiques pour diminuer la douleur du patient, le practicien peut également lui administré des sédatifs pour réduire son anxiété, sa nervosité et permettre de le tranquilliser pour éviter tout réflexe négatif durant l’acte chirurgical.
Les sédatifs font partie de la classe des hypnotiques, leur fonctionnement est donc identique.
Les plus courants sont :



